การจัดเรียงอิเล็กตรอน: รากฐานของเคมีที่คุณควรรู้
คำนำ
การจัดเรียงอิเล็กตรอนเป็นหัวใจสำคัญของเคมี เนื่องจากอธิบายถึงพฤติกรรมและคุณสมบัติของธาตุต่างๆ ได้อย่างแม่นยำ การเข้าใจคอนเซ็ปต์นี้เป็นสิ่งจำเป็นสำหรับนักเรียนวิทย์ นักวิทยาศาสตร์ และผู้ที่สนใจในโลกแห่งอะตอม
โมเดลการจัดเรียงอิเล็กตรอน
โมเดลกลศาสตร์ควอนตัม
โมเดลกลศาสตร์ควอนตัมอธิบายว่าอิเล็กตรอนไม่ใช่แค่ประจุลบเล็กๆ แต่ยังมีลักษณะคล้ายคลื่นอีกด้วย อิเล็กตรอนเคลื่อนที่เป็นคลื่นความน่าจะเป็นในวงโคจรอะตอม ซึ่งกำหนดโดยระดับพลังงานที่อนุญาตของแต่ละวงโคจร
การกำหนดระดับพลังงาน
ระดับพลังงานของวงโคจรอะตอมจะถูกกำหนดโดยสามจำนวนควอนตัม ได้แก่:
-
จำนวนควอนตัมหลัก (n): บอกระดับพลังงานหลักของวงโคจร มีค่าเป็นจำนวนเต็มบวกที่ไม่เป็นศูนย์ (n = 1, 2, 3, ...)
-
จำนวนควอนตัมโมเมนตัมเชิงมุม (l): บอกรูปร่างของวงโคจร มีค่าเป็นจำนวนเต็มที่ไม่เป็นลบซึ่งน้อยกว่า n (l = 0, 1, 2, ..., n-1)
-
จำนวนควอนตัมแม่เหล็กสปิน (ms): บอกการหมุนของอิเล็กตรอน มีค่าเป็น ±1/2
การกำหนดวงโคจรอะตอม
วงโคจรอะตอมเป็นบริเวณที่มีความน่าจะเป็นสูงสุดที่พบอิเล็กตรอน แต่ละวงโคจรมีรูปร่างและพลังงานจำเพาะ โดยกำหนดโดยสามจำนวนควอนตัมดังกล่าวข้างต้น
กฎการจัดเรียงอิเล็กตรอน
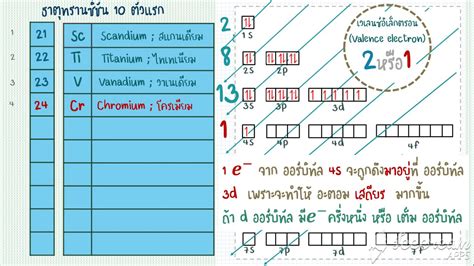
มีกฎเกณฑ์หลายประการที่กำหนดว่าอิเล็กตรอนจะจัดเรียงตัวอยู่ในวงโคจรอะตอมอย่างไร กฎเหล่านี้ได้แก่:

-
หลักการกีดกันของเพาลี (Pauli Exclusion Principle): ไม่มีอิเล็กตรอนสองตัวใดที่มีสี่จำนวนควอนตัมเหมือนกันได้
-
กฎของฮุนด์ (Hund's Rule): อิเล็กตรอนในวงโคจรที่มีพลังงานเท่ากันจะจัดเรียงตัวให้มีสปินขนานกันให้มากที่สุด
-
หลักการAufbau (Aufbau Principle): อิเล็กตรอนจะเติมเต็มวงโคจรที่มีพลังงานต่ำที่สุดก่อน
การกำหนดการกำหนดค่าอิเล็กตรอน
การกำหนดค่าอิเล็กตรอนเป็นการแสดงการจัดเรียงของอิเล็กตรอนในวงโคจรอะตอมของอะตอม ใช้สัญลักษณ์ต่อไปนี้:
- n: จำนวนควอนตัมหลัก (ระดับพลังงาน)
- l: จำนวนควอนตัมโมเมนตัมเชิงมุม (รูปร่าง)
- ตัวอักษร s, p, d, f: แสดงค่าของ l ที่สอดคล้องกัน
- ยกกำลังบน: แสดงจำนวนอิเล็กตรอนในวงโคจรนั้น
ตัวอย่างการกำหนดค่าอิเล็กตรอน
- ไฮโดรเจน (H): 1s¹
- ฮีเลียม (He): 1s²
- ลิเทียม (Li): 1s²2s¹
- ออกซิเจน (O): 1s²2s²2p⁴
ผลต่อคุณสมบัติของธาตุ
การจัดเรียงอิเล็กตรอนมีผลอย่างมากต่อคุณสมบัติของธาตุ ได้แก่:

-
สมบัติทางเคมี: จำนวนอิเล็กตรอนในวงโคจรชั้นนอกสุดกำหนดความว่องไวในการเกิดปฏิกิริยาของธาตุ
-
สมบัติทางกายภาพ: อิเล็กตรอนที่จัดเรียงอย่างหนาแน่นทำให้เกิดพันธะที่แข็งแรงระหว่างอะตอม ส่งผลให้ธาตุมีจุดหลอมเหลวและจุดเดือดสูง
ตารางการจัดเรียงอิเล็กตรอน
| จำนวนควอนตัม |
s |
p |
d |
f |
| l |
0 |
1 |
2 |
3 |
| รูปร่าง |
ทรงกลม |
ดัมเบล |
กลีบดอก |
ซับซ้อน |
| จำนวนวงโคจร |
1 |
3 |
5 |
7 |
ตารางจำนวนอิเล็กตรอนสูงสุดในแต่ละวงโคจร
| ระดับพลังงาน (n) |
s |
p |
d |
f |
| 1 |
2 |
- |
- |
- |
| 2 |
2 |
6 |
- |
- |
| 3 |
2 |
6 |
10 |
- |
| 4 |
2 |
6 |
10 |
14 |
เรื่องราวฮาๆ เกี่ยวกับการจัดเรียงอิเล็กตรอน
เรื่องที่ 1
มีอะตอมของออกซิเจนสองอะตอมนั่งอยู่ในร้านกาแฟ อะตอมหนึ่งบ่นว่า "ฉันรู้สึกแย่มาก ฉันมีอิเล็กตรอนที่ฉันต้องการจะกำจัดออกไป" อะตอมอีกตัวหัวเราะและพูดว่า "อะไรทำให้เธอคิดอย่างนั้น อย่าปล่อยให้อิเล็กตรอนไม่คู่มาทำให้เธอรู้สึกหงุดหงิดเลย" แต่แล้วอะตอมแรกก็ปฏิเสธว่า "แต่อิเล็กตรอนของฉันมันไม่คู่จริงๆ ฉันต้องการมันออกไปเพื่อที่ฉันจะได้มีวงโคจรที่สมบูรณ์"
สิ่งที่ได้เรียนรู้: การมีอิเล็กตรอนไม่คู่ทำให้ธาตุว่องไวในการเกิดปฏิกิริยามากขึ้น
เรื่องที่ 2
มีอะตอมของโซเดียมอยู่สองตัวกำลังวิ่งแข่งกัน อะตอมแรกพูดว่า "ฉันรู้จังหวะแล้ว ฉันแค่ต้องการอิเล็กตรอนอีกตัวเดียวฉันก็จะได้วงโคจรชั้นนอกสุดที่สมบูรณ์แล้ว" อะตอมที่สองพูดว่า "นั่นมันง่ายมากเลย ฉันมีอิเล็กตรอนที่ไม่คู่เกินอยู่แล้ว ฉันจะให้เธอได้มั้ย" อะตอมแรกดีใจมากและพูดว่า "เยี่ยมเลย ขอบคุณนะ" และทั้งสองก็วิ่งแข่งกันต่อไป
สิ่งที่ได้เรียนรู้: ธาตุที่มีอิเล็กตรอนชั้นนอกสุดเพียงไม่กี่ตัวมีแนวโน้มที่จะเกิดพันธะกับธาตุอื่นๆ
เรื่องที่ 3
มีอะตอมของโซเดียมอยู่สองตัวกำลังเล่นซ่อนหา อะตอมแรกพูดว่า "ฉันจะนับหนึ่งถึงสิบ แล้วเธอต้องไปซ่อนนะ" อะตอมที่สองก็รีบวิ่งออกไปและซ่อนอยู่ข้างหลังวงโคจรชั้นนอกสุดของอะตอมตัวอื่น อะตอมแรกที่เป็นคนนับ พอถึงสิบก็มองไปทางหลังวงโคจรชั้นนอกสุดของอะตอมตัวอื่น แล้วตะโกนว่า "เจอแล้ว"
สิ่งที่ได้เรียนรู้: อิเล็กตรอนในวงโคจรชั้นนอกสุดกำหนดขนาดของอะตอม
)
การเปรียบเทียบการจัดเรียงอิเล็กตรอนของธาตุต่างๆ
| ธาตุ |
การกำหนดค่าอิเล็กตรอน |
จำนวนอิเล็กตรอนวาล์ว |
คุณสมบัติ |
| ไฮโดรเจน |
1s¹ |
1 |
ก๊าซว่องไว |
| ฮีเลียม |
1s² |
0 |
ก๊าซเฉื่อย |
| ลิเทียม |
1s²2s¹ |
1 |
โลหะว่องไว |
| ออกซิเจน |
1s²2s²2p⁴ |
6 |
ก๊าซว่องไว |
| โซเดียม |
1s²2s²2p⁶3s¹ |
1 |
โลหะว่องไว |
คำถามที่พบบ่อย
1. อิเล็กตรอนที่ไม่คู่คืออะไร
อิเล็กตรอนที่ไม่คู่คืออิเล็กตรอนที่ไม่ได้จับคู่กับอิเล็กตรอนอื่นในวงโคจรเดียวกัน
2. หลักการAufbauคืออะไร
หลักการAufbauระบุว่าอิเล็กตรอนจะเติมเต็มวงโคจรที่มีพลังงานต่ำที่สุดก่อน
3. ฉันจะกำหนดการกำหนดค่าอิเล็กตรอนของอะตอมได้อย่างไร
ใช้ตารางการจัดเรียงอิเล็กตรอนเพื่อกำหนดจำนวนอิเล็กตรอนสูงสุดในแต่ละวงโคจร และใช้หลัก

